Niet volgens het boekje
Kanker gebruikt de biologische mechanismen van het lichaam – maar dan anders.
Door Ilse Boeren
Dit artikel verscheen origineel in het EOS Dossier "Als je lijf in brand staat" rond inflammatie. Lees meer op eoswetenschap.eu.
De tijd waarin onderzoekers dachten dat kanker alleen bestaat uit cellen die zich als gek vermenigvuldigen, is definitief voorbij. Wetenschappers aan het VIB – KU Leuven Centrum voor Kankerbiologie bestuderen ontstekingsreacties, want kanker gebruikt dezelfde mechanismen, maar dan anders. Deze aanpak geeft zicht op nieuwe behandelingen, zelfs tegen pancreaskanker, berucht om zijn slechte overlevingsratio.
De koffieruimte op de negende verdieping van een nieuwe labtoren op de campus Gasthuisberg is dé ontmoetingsplek voor onderzoekers, af en toe ook met journalisten. Zowel Kathryn Jacobs als Marcello Delfini willen daar afspreken voor de start van het gesprek over hun onderzoek. Hebben kankeronderzoekers – want dat zijn ze, elk in hun eigen domein – een grote behoefte aan cafeïne?
‘Het onderzoek is alleszins een uitdaging, want alles wat je ontdekt is nieuw.’ Delfini is biotechnoloog met een specialisatie in immunologie, en een grote liefde voor macrofagen – ‘de mooiste cellen van het immuunsysteem’. De Italiaan kwam na een doctoraat in Frankrijk terecht bij het VIB voor onderzoek naar de micro-omgeving van tumoren. ‘Ik kan ons werk vergelijken met een puzzel leggen waarvan je de doos niet meer hebt. Je weet dat alle stukjes in elkaar moeten passen, maar je hebt geen voorbeeld om je naar te richten.’
De Amerikaanse postdoc Jacobs promoveerde met een onderzoek naar glioblastomen (hersentumoren) en specialiseert zich nu in de biologie van bijzondere bloedvaten in tumoren – én in de lymfeklieren. Zij deelt Delfini’s inzicht. ‘Ik heb tijdens mijn PhD ontdekt dat je wat je geleerd hebt in je schooltijd mag vergeten wanneer je met tumoren werkt. Vooral als het om signaalroutes gaat. Dan doet een tumor niets volgens het boekje.’
In het begin ging kankeronderzoek vooral over de vraag hoe een cel zich als gek kon beginnen delen. Therapieën deden niets meer – ook niets minder – dan kankercellen stoppen en doden. ‘Chemotherapie en radiotherapie creëren genetische instabiliteit en doen het aantal mutaties toenemen in cellen die zich snel vermeerderen’, vertelt Delfini. Tot er zoveel fouten in hun genetische code zitten dat die cellen niet meer kunnen overleven. Omdat die therapieën werken op alle cellen die zich snel vermenigvuldigen – haar, huid, ogen – hebben ze erg veel bijwerkingen.
Gekaapt immuunsysteem
Al is het natuurlijk ook zo: kankercellen woekeren op een ongecontroleerde manier, én ze sterven niet. ‘Voor de embryonale ontwikkeling, maar ook voor de stabiele toestand van organen is celdood superbelangrijk, en kankercellen slagen erin om die te vermijden.’ In de jaren 1980 werd duidelijk dat tumoren de immuunrespons van ons lichaam kapen, om alles te behouden wat positief is voor de groei van de tumor en het uitzaaien van de kankercellen, en alles te blokkeren wat er negatief voor is.
Maar een tumor bestaat dus niet grotendeels uit sneldelende kankercellen. Dat denken, is naïef, volgens de onderzoeker. ‘Nu begrijpen we dat een tumor een complex systeem is.’ Een tumor heeft bloedvaten om hem van voedingsstoffen te voorzien. Hij bevat fibroblasten die zorgen voor structuur en stevigheid. ‘Er zijn veel stromacellen, differentiërende cellen die de groei van de tumor bevorderen, en er is een waanzinnige hoeveelheid immuuncellen binnenin de tumor, en dan voornamelijk macrofagen – hun aandeel kan oplopen tot wel zestig procent.’
De ontdekking dat immuuncellen infiltreren in het kankerweefsel én dat het immuunsysteem de potentie heeft om een kankercel te herkennen en te doden, leidde tot de introductie van immuuntherapie. Een gamechanger, volgens Delfini, ‘maar jammer genoeg maar bij een deel van de patiënten. Er zijn veel mensen die resistent zijn tegen immuuntherapie.’ En er zijn kankers die heel moeilijk te behandelen zijn. ‘Pancreaskanker, om er een te noemen. De levensverwachting is heel kort.’
‘In ons lab werken we aan mechanismen van resistentie tegen immuuntherapie, via de tumormicro-omgeving’, gaat de onderzoeker verder. De vele verschillende celtypes in een tumor bevinden zich immers niet gewoon op dezelfde plek waar ze onafhankelijk van elkaar hun leven leiden. ‘Ze vormen een ecosysteem: een complex netwerk van interactie. En de metabolische routes die ze ontwikkelen, hebben een enorm effect op hoe goed immunotherapie werkt.’
Kanker stopt aan de ene kant de antitumorreactie van het immuunsysteem: hij kaapt daarvoor onze mechanismen die de immuunrespons temperen om auto-immuunziekten te vermijden. Aan de andere kant kaapt hij ook het wondgenezingsproces, een andere functie van het immuunsysteem. ‘Het behoud van of het terugkeren naar homeostase, de normale toestand, zeg maar. Toen dat ontdekt werd, vergeleken onderzoekers kanker met een wonde die niet geneest.’

In zijn eigen voordeel
Daar ligt ook de link met ontstekingsreacties. ‘Dat is immers een heel breed begrip.’ De wetenschappelijke definitie van een ontsteking is: de reactie van ons lichaam wanneer de homeostase om welke reden dan ook wordt doorbroken, om het terug te brengen naar de oorspronkelijke toestand. ‘Eerst moet het immuunsysteem de situatie beoordelen. Is er een infectie, zijn er ziekteverwekkers die opgeruimd moeten worden?’ Daarna, als alle pathogenen verdwenen zijn, moet de eventuele wonde toe.
‘Al deze dingen gebeuren ook bij kanker’, legt Delfini uit. Die heeft een ontstekingsremmende omgeving nodig, omdat er geen cytotoxische T-cellen mogen worden geactiveerd die de kankercellen vernietigen. En hij gebruikt de wondgenezingsreactie. ‘De tumor moet groeien, heeft bloedvaten nodig en een structuur.’ Kanker kan dus processen die in onze biologie zijn gecodeerd om te repareren, in zijn eigen voordeel gebruiken.
‘Dat is wat de kankercel begrijpt.’ Delfini nuanceert zijn uitspraak snel: een kankercel begrijpt natuurlijk niets, het is maar een cel. ‘Maar evolutionair gezien zullen kankercellen die zo’n mechanisme in hun eigen voordeel kunnen uitbuiten, zich meer vermenigvuldigen dan andere. Zo leert kanker dus tijdens zijn evolutie.’
Ook Kathryn Jacobs zag een voorbeeld van het extreme aanpassingsvermogen van kankercellen tijdens haar doctoraat. ‘Er bestaan kankerstamcellen.’ Bij chemotherapie en bestraling delen deze cellen niet meer, ze wachten gewoon af tot de therapie voorbij is. ‘Daarna gaan ze zich opnieuw reproduceren, maar hun nakomelingen zijn aangepast aan de chemo en de bestraling, en gaan er niet meer van dood.’
De vele verschillende cellen in een tumor hebben gemeen dat ze proberen te overleven in een vijandige omgeving. Een groot voordeel is daarbij de enorme mutatiesnelheid van kanker. ‘Die kan bijvoorbeeld overschakelen van een glucosemetabolisme naar een vetzuurmetabolisme of omgekeerd.’ Dat is volgens Jacobs ook de reden waarom veel onderzoeksgroepen zich richten op manieren om ons immuunsysteem te versterken in plaats van op de kankercellen zelf. ‘Die veranderen te snel. Ook onze onderzoeksgroep wil het immuunsysteem stimuleren’, gaat ze verder. ‘We willen de bloedvaten in tumoren immuunstimulerend maken, zodat de immuuncellen binnen kunnen. In ons ideale scenario induceren we hoogendotheliale venulen (HEV) en krijgen we nog meer immuuncellen.’
Een extra lymfeklier?
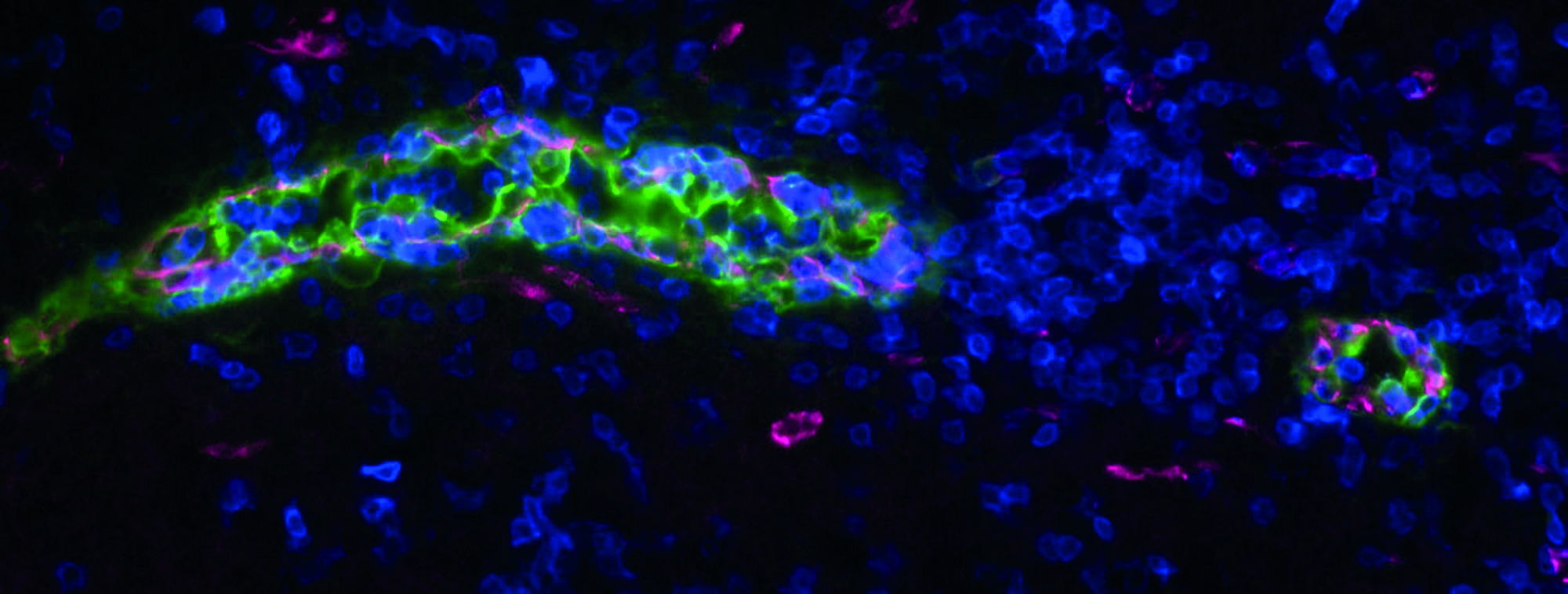
Jacobs’ onderzoek spitst zich toe op de biologie van die hoogendotheliale venulen. Venulen zijn microscopisch kleine bloedvaten die zuurstofarm bloed van de haarvaten verzamelen en dat richting aderen sturen. Hoogendotheliale venulen zijn een bijzonder type venule met een binnenlaag (endotheel) van kubusvormige cellen. Bij infectie zorgen ze voor meer lymfocyten, T-immuuncellen en B-immuuncellen dus, in de lymfeklier. Die vele cellen pikken allemaal het antigeensignaal op en verhogen zo de efficiëntie van het gevecht tegen alles wat ze in het lichaam moeten bestrijden.
‘Enkele jaren geleden werd ontdekt dat deze bloedvaten niet alleen in lymfeklieren en secundaire lymfoïde organen voorkomen, maar ook op buitengewone plaatsen in het lichaam.’ Daar ontstaan ze bij ontstekingsreacties. ‘Je kan ze bijvoorbeeld krijgen in je longen of als je uitslag hebt op je huid. Ze hebben daar ook hun vertrouwde functie: ze brengen veel immuuncellen naar die plek.’ Bij ontstekingen zou dat de prognose verslechteren, omdat patiënten eigenlijk te veel immuuncellen krijgen. Maar als HEV zich in de tumor ontwikkelen, verbetert dat juist de prognose.
‘Kanker jaagt het immuunsysteem weg. Extra HEV kunnen die immuunonderdrukking tegengaan door meer T-cellen en B-cellen binnen te brengen.’ Normaal gezien hebben bloedvaten in een tumor unieke oppervlaktemerkers die de immuuncellen aanmoedigen om door de tumor heen te gaan. ‘Als de immuuncellen dus wél naar buiten komen in de tumor, is dat geweldig, dan kunnen ze de tumor aanvallen. Vorig jaar heeft ons lab een artikel gepubliceerd over behandelingen om de vorming van HEV in de tumor te induceren.’
Vroeger dachten onderzoekers dat een anti-angiogene therapie, die ervoor zorgt dat er minder bloedvaten ontstaan, de tumor zou doden. ‘Ze dachten dat de tumor zou verhongeren.’ Maar ze ontdekten dat de bloedvaten in de tumor net gezonder werden, zodat de immuuncellen beter binnen konden komen. ‘Wij gebruikten ook een anti-angiogene therapie en voegden dan een immuuncheckpointblokkade toe. Die laatste blokkeert het signaal dat zegt dat de immuuncellen hun werk niet moeten doen.’ Het onderzoek kwam tot goede resultaten voor borstkanker, melanoom en darmkanker, allemaal in muismodellen.

Jacobs zelf doet onderzoek naar hoe HEV ontstaan in de tumor én in de lymfeklieren. ‘De lymfeklier heeft plaatsen waar B-immuuncellen en T-immuuncellen geconcentreerd zijn rond de HEV.’ De onderzoeksgroep zag hetzelfde in een tumor: B-cellen, T-cellen en HEV samen in een georganiseerde structuur. ‘Die noemen we tertiaire lymfoïde structuur, TLS. Tumoren met dit soort structuren hebben de beste prognose voor genezing. We zoeken dus nu een therapie om TLS te induceren.’
‘Tegelijkertijd kijken we in ons lab naar HEV en hun functionele biologie in de lymfeklier en hoe deze zich verhoudt tot die in de tumor.’ Een opvallende vaststelling daarbij is dat HEV in de tumor het best lijken op ontstoken HEV in de lymfeklier. ‘Achteraf is dat logisch, want de tumor is een ontstekingsomgeving.’
Minder melkzuur
Ook het team van Delfini boekte al successen richting nieuwe therapieën, door te redeneren vanuit de ontstekingsbiologie. Een van de promovendi in de groep, Federica Cappellesso, vond een manier om de rem op het immuunsysteem wat losser te maken in muizen met pancreaskanker. ‘Omdat het immuunsysteem zo sterk is in het vernietigen van alles wat niet in het lichaam thuishoort, moet het sterk gereguleerd worden. Ons lichaam kan niet riskeren dat het actief wordt tegen iets dat niet vernietigd moet worden – dat is trouwens het geval bij auto-immuunziekten.’
T-immuuncellen hebben dus een zelfregulerend mechanisme dat overmatige schade voorkomt. Als ze keer op keer hetzelfde antigen doden, raken ze uitgeput. Dan stoppen ze met aanvallen. ‘Het probleem is dat er in een tumor veel tumorcellen zijn.’ T-cellen raken dus snel uitgeput. ‘We vroegen ons af hoe we de uitputting van de T-immuuncellen konden tegengaan. Vergelijk het met het kopje koffie dat wij drinken als we moe zijn maar onze deadline nadert.’
De belangrijkste immuuntherapie van vandaag bestaat uit anti-PD-1-antilichamen. ‘De receptor PD-1 is een immuuncheckpoint, hij vormt een negatief signaal voor T-lymfocyten. Als PD-1 actief is in de T-cel, raakt ze uitgeput. De studie waar ik het over had en die ik supermooi vind, liep bij pancreaskanker.’ Daarbij werkt niet veel. ‘De reden hiervoor is dat er niet veel T-cellen in het pancreaskankerweefsel dringen. Als er geen T-cellen in het kankerweefsel zijn, kan je tegen ze blijven zeggen ‘word niet moe.’ Het zal niet baten.’
Wat Cappellesso ontdekte, is dat pancreaskanker een erg moeilijke micro-omgeving heeft. ‘Pancreaskankercellen hebben een specifiek transporteiwit dat ze gebruiken om bicarbonaat te importeren.’ Bicarbonaat is een sterke pH-buffer. ‘Hierdoor houden kankercellen de pH in hun binnenste neutraal. Ze kunnen dus meer glycolyse doen, meer energie produceren en zich meer vermenigvuldigen.’ Tegelijkertijd produceren ze meer melkzuur, het afval van hun metabolisme.
‘Ze kunnen niet alleen meer melkzuur produceren, ze kunnen ook meer melkzuur exporteren. De daling van de pH buiten de cel, door de aanwezigheid van veel melkzuur en weinig bicarbonaat, zorgt voor een zure micro-omgeving waarin de T-cellen hun werk niet kunnen doen.’ De onderzoekers slaagden erin om het transporteiwit te blokkeren. Zo deden ze iets wat niet goed is voor de kankercel. ‘Die heeft minder mogelijkheden om haar pH neutraal te houden, waardoor haar metabolische capaciteit wat lager is.’ Maar ook de T-cellen varen er wel bij. ‘Minder metabolisme betekent minder melkzuuruitstoot. Samen met de kleinere bicarbonaatimport zorgt dat voor een minder zure omgeving buiten de cel, zodat de T-cellen daar normaal kunnen functioneren.’
(G)een uitweg
Het grote voordeel van zulke therapieën – buiten het feit dat ze werken bij moeilijke kankers en een uitweg bieden tegen resistentie voor immuuntherapie – is dat ze weinig bijwerkingen hebben. ‘Dat transporteiwit, ons doelwit, is heel specifiek voor pancreaskanker. We kunnen zijn functie afremmen zonder dat er grote veranderingen optreden in de rest van het lichaam van de patiënt.’
En voor de patiënt doen de onderzoekers het toch. ‘We zijn bezig met patentaanvragen, want het resultaat van ons onderzoek moet naar buiten, het moet naar de mensen.’ Delfini vindt dat het grote voordeel van werken voor zijn instituut. ‘De processen begrijpen is op zich heel mooi, maar het feit dat onze wetenschap ergens een toepassing vindt, is voor mij erg belangrijk.’
Dat zal alleszins nog even duren. ‘Je weet hoe het gaat. Eerst de jaren werk van onze promovendus, nu de finetuning en patentaanvragen. Dan kan er een farmabedrijf mee aan de slag om een geneesmiddel te maken. Maar dat moet natuurlijk ook nog door klinische testen.’ Delfini vindt het resultaat alle tijd, geld en moeite waard, al was het oorspronkelijk nooit zijn bedoeling om kankeronderzoeker te worden. ‘Ik wilde iets helemaal anders doen. Maar dit onderzoek is zo mooi. Plots zat ik er middenin, er was geen uitweg meer.’
Dit artikel verscheen origineel in het EOS Dossier "Als je lijf in brand staat" rond inflammatie. Lees meer op eoswetenschap.eu.
Lees meer